
理解酶序列、折叠稳定性和催化活性之间的复杂关系对于工业和生物医学应用至关重要。然而,目前的酶分析技术受限于无法同时解析稳定性和活性表型,以及无法将这些表型与大规模的基因序列相结合。
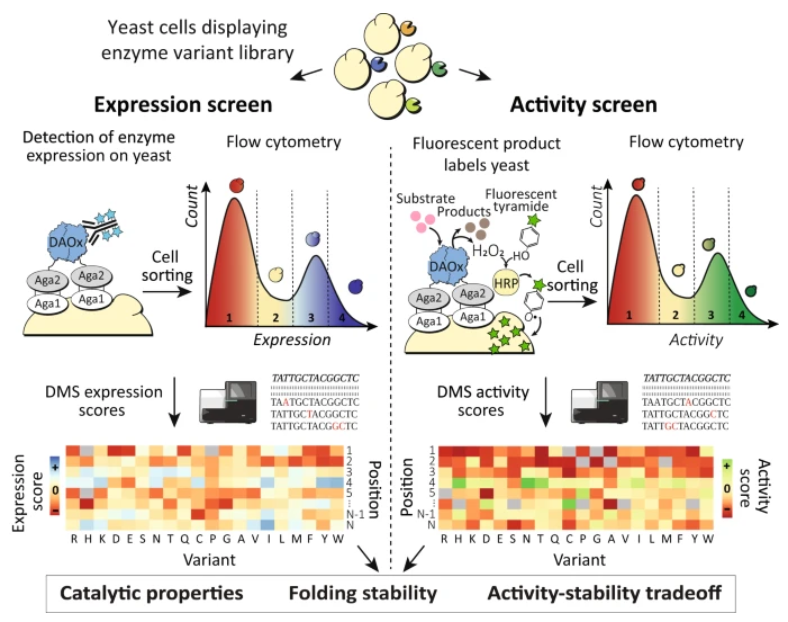
巴塞尔大学Michael A. Nash和Rosario Vanella等介绍了酶邻近测序的发展,这是一种深度突变扫描方法,利用过氧化物酶介导的单细胞保真自由基标记来剖析单个实验中数千种突变对氧化还原酶稳定性和催化活性的影响。
本文要点:
(1)
作者使用酶邻近测序来分析6399个错义突变如何影响纤细红酵母D-氨基酸氧化酶的折叠稳定性和催化活性。由此产生的数据集证明了在自然进化过程中限制折叠稳定性的基于活性的约束,并确定了远离活性位点的热点作为突变的候选,这些突变在不牺牲稳定性的情况下提高了催化活性。
(2)
酶邻近测序可以扩展到其他酶类,并为控制酶结构和功能的生物物理原理提供有价值的见解。
参考电竞投注官网 :
Vanella, R., Küng, C., Schoepfer, A.A. et al. Understanding activity-stability tradeoffs in biocatalysts by enzyme proximity sequencing. Nat Commun 15, 1807 (2024).
DOI: 10.1038/s41467-024-45630-3
https://doi.org/10.1038/s41467-024-45630-3


















