ACS Nano:嵌合抗原受体工程化细胞膜包被的纳米颗粒可促进基于双靶向mRNA的癌症基因治疗
 柚子
柚子
基于mRNA的基因疗法进一步推动了癌症治疗的发展。然而,肿瘤靶向递送方法有限等问题仍会严重限制该策略的临床应用,并且会导致脱靶效应和安全性风险。嵌合抗原受体(CAR)分子使T细胞能够以不依赖主要组织相容性复合物的方式识别特定抗原。CAR方法为细胞膜引入额外的靶向功能提供了一种有效的解决方案。具有同型肿瘤靶向特性的癌细胞膜包被纳米粒子为基因工程和膜提取提供了一个重要平台。有鉴于此,四川大学Ke Men、Wei Wang和电子科技大学段醒妹教授构建了一个仿CAR的癌细胞膜包被平台,其可通过双重肿瘤靶向机制递送mRNA制剂。
本文要点:
(1)研究者利用简化的人表皮生长因子受体2(HER2)特异性CAR分子(包括细胞外HER2结合结构域、铰链区和跨膜结构域)对癌细胞的细胞膜进行工程化,以构建CAR-CT26细胞。随后,研究者将提取的CAR-CT26膜(CARM)包覆在脂质纳米颗粒(LNP)-mRNA表面,以形成CARM@LNP-mRNA复合物。在体外,CARM包被的纳米颗粒能够在过表达靶HER2抗原的CT26细胞中表现出更高的mRNA转染效率。
(2)在HER2+ CT26皮下肿瘤和腹腔转移模型中,与CT26细胞膜包被的对照组相比,系统给药的CARM@LNP-mRNA制剂能够表现出更强的肿瘤靶向能力和肿瘤抑制作用。实验结果表明,CARM@LNP是实现基于mRNA的基因疗法的可行选择。综上所述,该研究开发的CARM@LNP-mRNA能够为实现肿瘤靶向治疗提供一个新的策略。
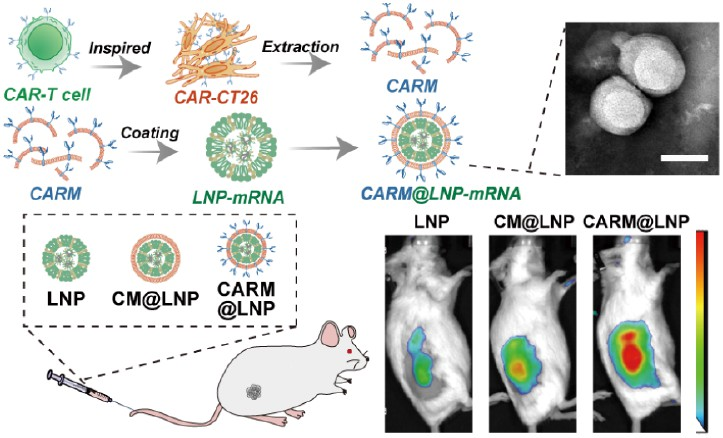
Sibei Lei. et al. Chimeric Antigen Receptor-Engineered Cell Membrane-Coated Nanoparticles Promote Dual-Targeted mRNA-Based Cancer Gene Therapy. ACS Nano. 2025
DOI: 10.1021/acsnano.4c18153
https://pubs.acs.org/doi/10.1021/acsnano.4c18153
版权声明:
本平台根据相关科技华体汇下注平台 电竞投注官网 、教材以及网站编译整理的内容,仅用于对相关科学作品的介绍、评论以及课堂教学或科学研究,不得作为商业用途。


